近日,广州海洋实验室海洋动物适应机制研究及进化医学资源挖掘团队在生物学一区Top期刊Molecular Biology and Evolution上发表题为“Evolutionary dampening of Wnt signaling may contribute to naturally ascrotal testes in mammals”的研究文章,杨光教授为论文的通讯作者,团队科研骨干柴思敏博士为第一作者。该研究通过比较基因组和转录组分析、结合功能实验,发现哺乳动物Wnt信号通路基因通过分子演化和表达调控导致的负调控增强可能是其天然“隐睾”表型演化的分子机制之一。

绝大多数雄性哺乳动物的性腺(睾丸)在发育过程中从腹腔逐步下降至阴囊,这是一个复杂、具有性二态性的哺乳动物特有的发育过程。该过程依赖于引带(gubernaculum)的发育与迁移,由多种基因与信号通路共同调控。自然界中存在一些天然“隐睾”哺乳动物(如鲸豚类、单孔目和非洲兽总目物种),睾丸终生留存腹腔或腹股沟区域,是探究哺乳动物睾丸位置表型多样性的天然野生动物类群,同时为深入揭示人类和家畜隐睾疾病分子机制具有重要意义。Wnt信号通路在性腺与肌肉发育中至关重要,相关基因突变可导致引带发育不全与睾丸下降障碍。然而,基于Wnt信号通路对哺乳动物间睾丸位置表型差异背后的演化模式与分子机制仍缺乏系统研究。
研究团队首先通过对Wnt信号通路基因及其潜在非编码调控区进行演化分析,发现天然“隐睾”哺乳动物支系特有的氨基酸和核苷酸替换、正选择和加速演化等信号主要集中在该信号通路具有负调控功能的组分。其中,E3泛素连接酶家族成员ZNRF3主要通过调节Wnt受体复合物的稳定性来抑制信号的活化,天然“隐睾”哺乳动物独特的S406G位于与DVLs结合的DIR功能域,推测该氨基酸替换可能通过影响ZNRF3和DVLs的结合和互作来改变Wnt信号的传导(图1)。
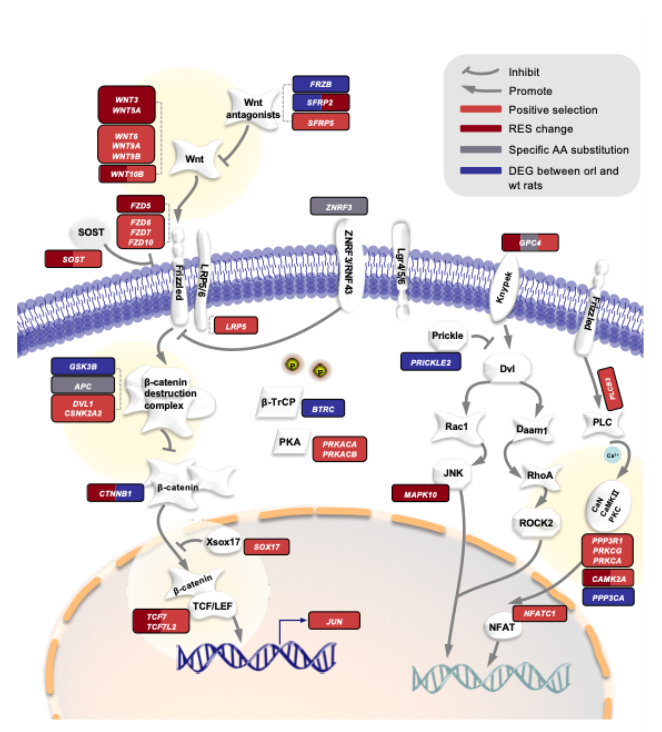
图1. 天然“隐睾”哺乳动物Wnt信号通路基因的分子演化。
进一步的分子对接和体外实验证明,ZNRF3 S406G能够显著改变与DVLs的结合能力,并可通过加强Wnt信号通路的抑制来进一步抑制细胞迁移能力(图2),提示天然“隐睾”哺乳动物ZNRF3 S406G在引带组织中的表达可能通过削弱Wnt信号通路介导的细胞迁移来影响引带组织的发育和牵引睾丸下降的能力。另外,双荧光素酶报告基因实验也表明,天然“隐睾”哺乳动物独特的保守非编码调控区的核苷酸变异能够显著改变靶基因的表达。

图2. “隐睾”哺乳动物ZNRF3 G406S导致蛋白结合能力、细胞迁移的改变。
研究团队接下来重新分析和挖掘野生型(wt)和自发隐睾大鼠(orl)品系睾丸下降第二阶段引带组织的转录数据,发现orl隐睾大鼠引带组织的部分Wnt信号通路的基因表达与wt大鼠有显著不同:表达量高的差异表达基因大多具有该通路的负调控功能,而表达量低的基因均为正调控基因,进一步支持Wnt信号通路的负调控增强与哺乳动物天然“隐睾”表型的形成有关(图3)。
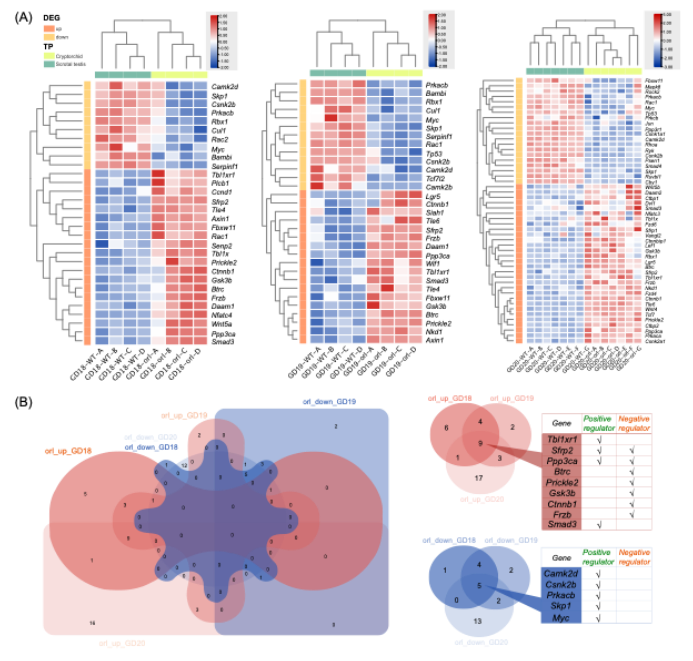
图3. Wnt信号通路基因在阴囊型睾丸(野生型)与自发隐睾(orl品系)大鼠间呈现显著不同的表达特征。
综上所述,本研究综合分子演化、转录组和体外细胞功能实验,揭示了基于Wnt信号通路的哺乳动物睾丸下降以及天然“隐睾”表型形成的分子机制。发现天然“隐睾”哺乳动物在Wnt信号通路的蛋白质编码基因和保守非编码调控序列中具有特异性变化。其中,ZNRF3的独特氨基酸替换(S406G)可显著抑制Wnt信号以及Wnt信号介导的细胞迁移。同时,在自发隐睾orl大鼠引带组织中观察到正调控关键基因的表达下调、负调控组分的表达上调。这些证据共同提示Wnt信号的抑制在哺乳动物睾丸位置表型多样性演化中的关键作用,并为理解人类及动物隐睾症的遗传机制提供了新的启示。
该研究得到了国家自然科学基金青年基金C类、中国博士后基金面上项目、科技部重点研发计划、广州海洋实验室PI项目的联合资助。

 IOA登录
IOA登录 邮箱登录
邮箱登录 网站地图
网站地图 联系我们
联系我们 香港分部
香港分部 EN / 中文
EN / 中文




